|
新聞中心
高錳酸鉀氧化吸收煙氣中單質汞的反應條件1717
發表時間:2021-04-14 17:37作者:劉盛余來源:環境工程學報 摘要:在鼓泡反應器中考察了高錳酸鉀氧化單質汞(Hg)的影響因素和機理,研究結果表明,KMnO4和Hg的反應很快,去除率隨KMnO4增加而增加;汞的進口濃度對汞的去除率影響不大;隨pH值的升高汞的去除率先降低后增加,在強酸性(pH=0)下Hg去除率最大,為92.4%,當pH值超過11隨pH值的升高而增加。在不同酸堿體系中,Hg和KMnO4反應過程是不同的。在酸性條件下H+提高了體系的氧化還原電勢,同時生成的Mn2+對本反應具有自催化作用。中性及堿性條件下,除氧化Hg外,KMnO4還原為MnO2對Hg有吸附作用,在強堿性條件下KMnO4將OH-氧化成OH從而使得自由基·OH氧化去除Hg。 關鍵詞:高錳酸鉀;pH值;單質汞氧化;吸收 一、概述 單質汞(Hg)是燃煤煙氣中汞的主要形式之一,它具有較高的揮發性和較低的水溶性,極易在大氣中通過長距離的大氣運輸形成全球性的汞污染,它在大氣中的平均停留時間長達半年至2年,是最難控制的形態之一,也是燃煤煙氣脫汞的難點。氧化吸收法主要是利用現有的脫硫裝置(WFGD)同時脫硫脫汞,實現多污染物聯合控制,被認為是最適合中國國情的一種煙氣脫汞方法。但是由于脫硫裝置只能脫除氧化形式的汞,對Hg基本沒有脫除效果,為此許多研究者向煙氣中添加氧化劑,將Hg氧化成Hg2+,增加汞的去除率。目前用于氧化脫汞的氧化劑KMnO4、K2S2O8、NaClO2(或KClO2)、NaClO3(或KClO3)、NaClO4(或KClO4)和O3等。 KMnO4是常用的氧化劑之一,有較強的氧化性,能與許多無機物和有機物發生反應,高錳酸鉀廣泛用于飲用水和廢水中有機污染物的氧化處理。KMnO4水溶液是吸收元素汞蒸氣一種有效的吸收劑,EPA方法29就是用酸性高錳酸鉀溶液做吸收劑測定氣相中的元素汞,高錳酸鉀溶液在煙氣采樣過程中用于收集汞。盡管高錳酸鉀很昂貴,但是去除低濃度汞的效率高,商業上仍可能用于空氣污染控制或其他氣體脫汞。葉群峰等利用雙攪拌反應器研究了高錳酸鉀與汞的二級反應速度,但未能詳細研究吸收過程中的各種影響因素。為此,本實驗重點考察高錳酸鉀氧化吸收Hg的影響因素及其機理。
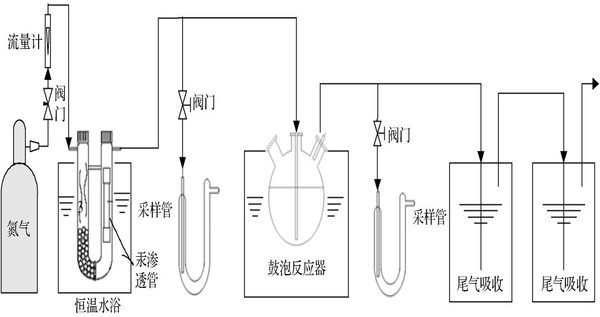
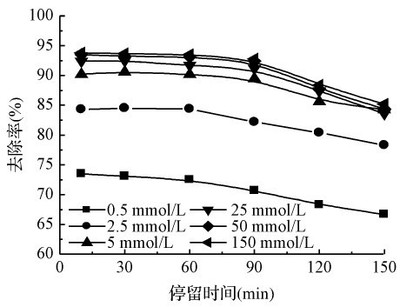
圖1實驗裝置圖 Fig.1Schematicdiagramofexperimentalapparatus 首先,將350mL的次氯酸鉀溶液加入反應器,在采樣管中加入20mL吸收液,質量濃度分別為H2SO4=10%和KMnO4=4%,打開氮氣閥門以及恒溫水浴鍋,調節氣體流量和水浴鍋溫度,鋼瓶中的氮氣作為載氣通過U型管,將汞滲透管揮發出來的元素汞帶出,通過反應器,尾氣用高錳酸鉀溶液吸收凈化后排空,穩定0.5h后,氣體通路轉向采樣管采樣,取樣時間為5min,取樣結束后排空,當氣體通入反應器時開始計時,每隔一定時間采一次樣。汞濃度采用原子熒光光度法(AFS—820原子熒光光度計)進行測定,通過測定進入鼓泡反應器前后Hg的濃度,得到Hg的氧化去除率。 二、 實驗結果與討論 2.1 KMnO4初始濃度對氧化吸收Hg的影響 在載氣流速Q=0.1Nm3/h、汞滲透管滲透溫度T1=343K、吸收液反應溫度T2=298K、反應液體積V=350mL、H2SO4濃度=1mol/L的條件下,考察了不同高錳酸鉀濃度對Hg去除率η的影響規律。由圖2可知,KMnO4和Hg的反應很快,η隨KMnO4濃度增加而增加,當KMnO4濃度為0.5mmol/L時,運行10min后,η為73.5%。而KMnO4濃度為2.5、5、25、50和150mmol/L時,同樣條件下,去除率分別上升到84.3%、90.2%、92.4%、93.5%和93.8%。 這是由于MnO4-|Mn2+的電極電勢與KMnO4的濃度有關,當KMnO4的濃度越高,MnO4-|Mn2+的電極電勢越高,因此,提高KMnO4的濃度有利于提高Hg的去除率。但是由于Hg不溶于水,其氧化速率也受控于Hg從氣相溶解進入液相的傳質速率,因此繼續提高KMnO4的濃度,其Hg的去除率趨于平穩。
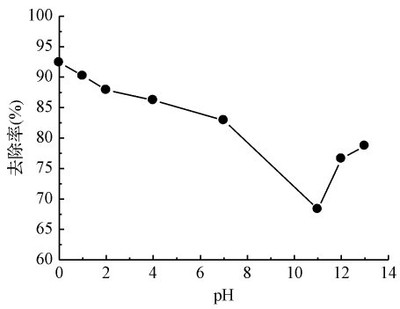
圖2 高錳酸鉀濃度的影響 Fig.2 EffectofKMnO4concentrationonHgremoval 2.2 pH值對KMnO4氧化Hg的影響 在載氣流速Q=0.1Nm3/h、汞滲透管滲透溫度T1=343K、吸收液反應溫度T2=298K、反應液體積V=350mL、KMnO4濃度=5mmol/L的條件下,考察不同pH值對Hg去除率η的影響,如圖3所示。
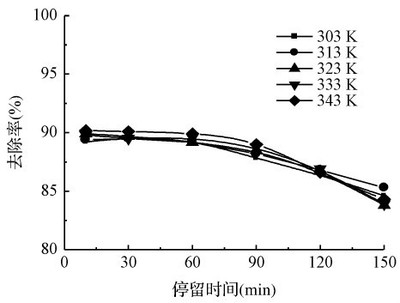
圖3 pH值對汞去除率的影響 Fig.3 EffectofpHonHgremoval 當KMnO4濃度=5mmol/L時,在強酸性(pH=0)下η最大,為92.4%,依次是酸性(pH=1),η=90.2%,中性(pH=7),η=82.9%和堿性(pH=11),η=68.3%。但隨著pH繼續升高,η反而呈上升趨勢,如pH=12,η=76.6%;pH=13,η=78.7%。 由圖3可知,高錳酸鉀氧化煙氣中Hg隨pH值的升高而降低,但是當pH值超過11,Hg的去除率增加。pH值在高錳酸鉀氧化Hg中是一個關鍵因素。pH顯著影響KMnO4氧化動力學和反應路徑,在不同pH值條件下,KMnO4轉移的電子數、反應速率和相應的標準電勢也不一樣,由Nernst方程可知,氧化還原電勢φ=φ0+0.01184lg[c(H+)],φ隨pH值的降低而升高,氧化性增強,故強酸條件下Hg去除率最大。由電勢φ可知,當pH≥7時是不能氧化Hg的,但圖3卻顯示在堿性條件可發生氧化,其原因是KMnO4在堿性條件下將OH-氧化成·OH從而使得自由基·OH氧化去除Hg。 2.3進口汞濃度對氧化吸收Hg的影響 實際燃煤煙氣由于燃燒方式、煤種、空氣污染控制設施的不同,含汞量也相差很大。實驗中是通過改變汞滲透管滲透溫度來改變初始汞濃度,因此可用T1表示初始汞濃度。在載氣流量Q=0.1Nm3/h、吸收液反應溫度T2=298K、反應液體積V=350mL、KMnO4濃度=5mmol/L、H2SO4濃度=1mol/L的條件下,考察不同滲透溫度T1對Hg去除率η的影響,結果如圖4所示。
圖4 初始汞濃度對汞去除率的影響 Fig.4EffectofinitialmercuryconcentrationonHgremoval 由圖4可知,圖上的曲線基本呈線性變化。T1由303K上升到343K,在相同KMnO4濃度下,對應的去除率略有上升,但變化不大。原因可能是:(1)隨著T1的升高,汞濃度增大,氣相推動力增加,傳質增強,反應速度增大,但由于吸收劑過量,在一定的運行時間內,去除率幾乎不變。(2)隨著Hg初始濃度的升高,雖然KMnO4氧化吸收Hg的絕對量增加,但其相對于Hg初始濃度的去除率η基本不變。兩方面綜合的最終結果是去除率η隨著初始汞濃度的升高基本不變,因此,進口Hg濃度的影響可以忽略不計。 三、高錳酸鉀氧化Hg的機理 由圖4可知,pH顯著影響KMnO4氧化動力學和反應路徑,在不同pH值條件下,KMnO4轉移的電子數、反應速率和相應的標準電勢也不一樣,見表1。
表1 KMnO4氧化還原反應及標準電極電勢 Table1RedoxreactionsandtheirpotentialsofvariouscouplesofKMnO4ions 標半電池反應 電極電勢φ0(V) pH范圍 MnO4-+8H+ + 5e→Mn2++4H2O1.51 ﹤3.5 MnO4-+4H+ + 3e→MnO2+2H2O1.70 3.5~7 4+2H2O+3e→MnO2+4OH 0.60 7~12 MnO4-+e→MnO42- 0.56 ﹥12 KMnO4在不同酸堿體系中,Hg和KMnO4可能的化學方程式如下: (1)在強酸環境下,KMnO4與Hg的反應式如下: 5Hg+2MnO4-+16H+→5Hg2++2Mn2++8H2O (2)在弱酸環境下,KMnO4與Hg的反應式如下: 3Hg+2MnO4-+8H+→3Hg2++2MnO2+4H2O (3)在中性/弱堿性環境下,KMnO4與Hg的反應 式如下: 3Hg+2MnO4-+H2O→3HgO+2OH-+2MnO2 (4)在強堿性環境下,KMnO4與Hg的反應式如下: Hg+2MnO4-+OH-→HgO+2MnO24-+H2O (5)在強酸環境下,KMnO4與Hg的反應的半電池反應及熱力學標準平衡常數Kθ(298.15K)的計算如下:負極:5Hg-10e→5Hg2+ε0-=0.851V (6)正極:2MnO4-+16H++10e→2Mn2++8H2O ε0+=1.507V (7) Nernst方程式為:lgK=2.303RT (8) K=10110.39 (9) 式中:n為氧化還原轉移的電子數;ε0+為正極的標準電極電勢(V);ε0-為負極的標準電極電勢(V);R為摩爾氣體常數(J/(mol·K));T為絕對溫度(K)。可以看出這是一個進行得極為完全的自發反應,且反應速度很快。因此從熱力學上認為用KMnO4做氧化劑吸收Hg是很合適的。由Nernst方程式可知,在強酸條件下KMnO4氧化Hg的效果最好。另一方面,由式(2),KMnO4在強酸性條件下被還原生成Mn2+,而Mn2+具有自催化作用,通過生成中間氧化價態的Mn(Ⅵ、Ⅲ)進一步與Hg反應[13]。由KMnO4的氧化還原電勢可知,當pH≥7時是不能氧化Hg的,但圖3卻顯示在堿性條件可發生氧化,其原因是KMnO4在堿性條件下將OH-氧化成·OH從而使得自由基·OH氧化去除Hg[14]。另外KMnO4的還原產物MnO2對Hg有吸附作用。 四、結論 (1)KMnO4和Hg的反應很快,去除率隨KMnO4增加而增加;汞的進口濃度對汞的去除率影響不大;隨pH值的升高汞的去除率先降低后增加,在強酸性(pH=0)下單質汞去除率最大,為92.4%,當pH值超過11隨pH值的升高而增加。 (2)KMnO4氧化吸收Hg是一個進行得極為完全的自發反應,且反應速度很快。在不同酸堿體系中,Hg和KMnO4反應過程是不同的。在酸性條件下H+提高了體系的氧化還原電勢,同時生成的Mn2+對本反應具有自催化作用。中性及堿性條件下,除氧化Hg外,KMnO4還原為MnO2對Hg有吸附作用,在強堿性條件下KMnO4將OH-氧化成·OH從而使得自由基·OH氧化去除Hg。
|
||||||||||||||||||||||||||||||||